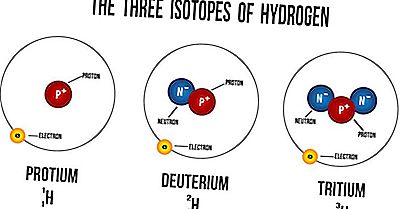
¿Qué es un isótopo?
Los isótopos son átomos del mismo elemento que tienen un número igual de protones pero diferentes números de neutrones. Sus números atómicos son los mismos, pero sus números masivos son diferentes. Los números masivos siempre se denotan por A, mientras que Z se refiere a los números atómicos de los elementos. El número atómico simboliza la cantidad de protones en el núcleo de un átomo y se usa para identificar la posición del elemento en la tabla periódica. El número de masa de un átomo es la cantidad de neutrones en su núcleo. Los isótopos de los elementos tienen diferentes propiedades físicas debido a la variación en sus masas atómicas. Debido a esta diferencia, dichos isótopos tienen diferentes densidades, así como puntos de fusión y ebullición. Sin embargo, los isótopos de un elemento siempre tienen propiedades químicas muy similares. La similitud se produce porque solo los electrones se usan en reacciones químicas, no en los neutrones o protones.
Historia de Isótopos
El radioquímico Fredrick Soddy sugirió por primera vez la existencia de isótopos en 1913 después de realizar estudios que implicaban la descomposición de las cadenas radiactivas. Durante sus experimentos, Soddy se dio cuenta de que existían cuarenta especies diferentes entre el plomo y el uranio, aunque la tabla periódica solo podía acomodar átomos 11. Después de que las pruebas químicas realizadas para separar algunos de estos elementos fallaran, sugirió que más de un tipo de átomo podría compartir la misma posición en la tabla periódica y denominarlos isótopos.
Ejemplos de isótopos
El cloro contiene dos isótopos principales: cloro-35 y cloro-37. Para llegar a esta conclusión, los científicos han descubierto que en una sustancia de cloro, las proporciones de cada uno de estos isótopos existen en general, y es por eso que las razones se utilizan para expresar la diferencia en cantidad. Estas proporciones son útiles al calcular los porcentajes relativos y las masas atómicas relativas. Otros ejemplos de isótopos incluyen carbono (carbono-12 y carbono-14 isótopos), oxígeno (oxígeno-16 y oxígeno-18) y fósforo (fósforo-31 es el isótopo principal, aunque también existen cantidades específicas de fósforo-32). Los isótopos de estos compuestos se consideran estables, y la mayoría de ellos tienen solo dos isótopos. Sin embargo, hay algunos elementos que tienen solo un isótopo, y estos incluyen flúor, berilio, arsénico, itrio, oro, aluminio, yodo, manganeso, sodio y niobio.
Purificación de isótopos
Hay tres áreas principales donde se aplican los isótopos. El primero es la separación de isótopos. La separación facilita la maximización de las propiedades de los átomos según sea necesario. En la separación de elementos más ligeros como el deuterio y el oxígeno, existe la aplicación del método de difusión de gases. La separación de elementos pesados como el uranio y el plutonio ocurre por espectrometría de masas.
Aplicación de isótopos
La primera aplicación de isótopos es su uso por los arqueólogos en la datación por carbono. Los isótopos son de dos tipos: isótopos estables y radiactivos. Los isótopos estables contienen la misma combinación de protones y neutrones y, como tales, no sufren descomposición. Por otro lado, los isótopos radiactivos tienen núcleos inestables y, por lo tanto, sufren descomposición. La desintegración radiactiva puede tardar tanto como 5,730 años, como el elemento de carbono. Los arqueólogos usan este componente de isótopos para determinar la edad de un objeto encontrado en excavaciones arqueológicas.








